UNIDAD II
|
|
PROCESO
Es una transformación termodinámica que experimenta un sistema cuando pasa de un estado de equilibrio inicial 1, caracterizado por unos determinados valores de las propiedades termodinámicas, a otro estado de equilibrio final 2, caracterizado por otros valores diferentes.
Cuando ocurre una compresión o una
expansión, interesa tener
en cuenta los diversos estados intermedios en los que sucesivamente
se encuentra el sistema desde que abandona el estado inicial hasta
que alcanza el estado final. Esta sucesión de estados intermedios es
lo que se conoce en termodinámica como trayectoria del proceso.
CAMBIO DE ESTADO
El cambio de estado ocurre siempre que el sistema interacciona con otro sistema o con el medio exterior. Esta interacción puede ser térmica (calor) o puede ser mecánica (trabajo). Se dice que el sistema ha cambiado de estado tan solo porque una de sus propiedades cambie.
CAMBIO DE ESTADO CUASIESTÁTICO
Es aquel en el que el estado del sistema se desvía del equilibrio solamente en cantidades infinitesimales a lo largo de todo el proceso y los parámetros que caracterizan al sistema varían de modo infinitesimalmente lento, de forma tal que el sistema siempre se encontrará en algún estado de equilibrio. Ejemplo: consideremos la presión P1 que ejerce un gas sobre la cara interna de un pistón sin rozamiento y sea P2 la que se ejerce sobre su cara externa. Haciendo equilibrio de fuerzas horizontales se tiene que las dos presiones son iguales debido a que las áreas son las mismas y no existe fuerza de roce. Si las dos presiones son iguales el pistón estará en equilibrio mientras que si P1 es infinitesimalmente superior a P2 el gas sufre una pequeña expansión, alcanzando un nuevo estado de equilibrio cuando ambas presiones se igualan. 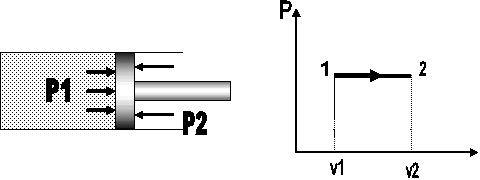
Fig. 2.6 Cambio de estado cuasiestático para un sistema
CAMBIO DE ESTADO NO-ESTÁTICO
Es el que se realiza a través de estados en los que no existe equilibrio. Cuando ocurre este cambio de estado, el sistema que se encontraba en equilibrio, evoluciona hacia estados en los cuales el sistema ya no podrá venir determinado por las propiedades termodinámicas, ya que no se encontrará en estado de equilibrio. Considerando como ejemplo el sistema de la Figura 2.7. El sistema está formado por dos balones de vidrio conectados a través de una válvula. Uno de ellos contiene un gas a la presión P1 y volumen específico v1 mientras que el otro se encuentra vacío. Al abrir la válvula el gas fluye rápidamente hacia el balón vacío hasta alcanzar el equilibrio, siendo la presión y el volumen específico P1 y v1 respectivamente. Es imposible definir estados de equilibrio entre el estado 1 y el estado 2 por lo que tampoco se puede trazar la trayectoria del proceso. 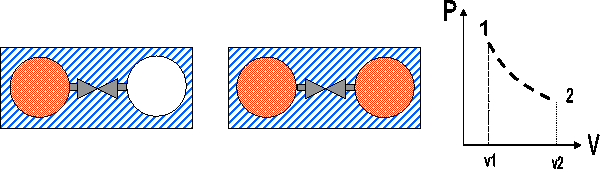
Fig. 2.7 Cambio de estado no-estático para un sistema.
PROCESO ISOMÉTRICO O ISOCÓRICO
Cuando el volumen del sistema permanece constante. Fig. 2.8 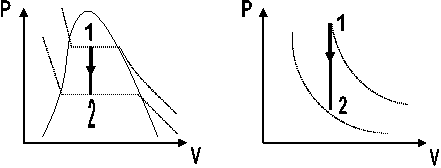
a) b)
Fig. 2.8. Proceso a volumen constante a) Sustancia Pura. b) Gas
Ideal.
PROCESO ISOBÁRICO
Cuando transcurre a presión constante. Fig. 2.9 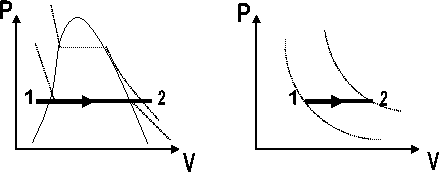
a) b)
Fig. 2.9. Proceso a presión constante. a) Sustancia Pura. b) Gas Idea
PROCESO ISOTÉRMICO Cuando el proceso tiene lugar a temperatura constante. Fig. 2.10 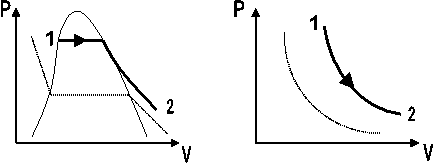
a) b)
Fig. 2.10 Proceso a temperatura constante. a) Sustancia Pura. b) Gas
Ideal
PROCESO ADIABÁTICO Cuando no hay transferencia de calor durante el proceso. Q=0
CICLO TERMODINÁMICO
Un sistema realiza un ciclo cuando experimenta una serie consecutiva de procesos volviendo a su estado de partida. Figura 2.11 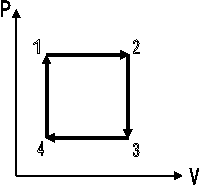
Fig. 2.11 Ciclo Termodinámico
PROCESO REVERSIBLE Cuando un proceso puede tener lugar en sentido inverso a aquel en el que se ha desarrollado y puede llegar a restaurar por completo el estado inicial y las cantidades energéticas transferidas se trata de un proceso reversible. El proceso reversible además de involucrar un cambio de estado cuasiestático, es necesario que esté libre de rozamientos en cualquier instante del proceso. En la Figura 2.12 es muestra la compresión de un gas en un arreglo cilindro émbolo sin rozamiento. Si después de comprimir el gas por efecto del peso, el pistón vuelve a su posición original sin alterar las cantidades energéticas, el proceso es reversible. 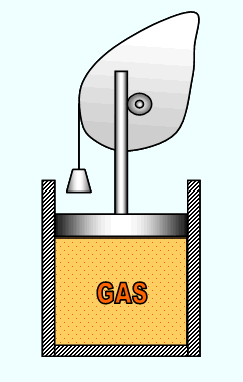
Fig. 2.12 Sistema que realiza un proceso reversible.
PROCESO IRREVERSIBLE
Si un sistema en el que
ha tenido lugar un proceso no puede
ser llevado a su estado inicial sin provocar variaciones en el espacio
exterior al sistema, el proceso se denomina irreversible. Todos los
procesos naturales son irreversibles es decir una vez desarrollado un
proceso natural, es imposible restablecer el estado inicial sin provocar
variaciones en el medio exterior del sistema o en otros sistemas.
|
