PRÁCTICA N° 3
SOLUBILIDAD
(Curva de solubilidad y cristalización
fraccionada)
I. OBJETIVO GENERAL
Establecer experimentalmente, la dependencia de la solubilidad con la
temperatura. Utilizar la variación de esta dependencia, para obtener sustancias
puras por cristalización fraccionada.
II. OBJETIVOS ESPECÍFICOS
Al finalizar la práctica el alumno será
capaz de:
1. Definir
solución y solubilidad.
2. Distinguir los tipos de soluciones según el
estado físico y de acuerdo a la cantidad relativa de sus componentes.
3. Determinar el efecto de la temperatura en la
solubilidad del nitrato de potasio (KNO3) y cloruro de sodio (NaCl).
4. Construir una curva de solubilidad en función
de la temperatura para cada compuesto (KNO3 y NaCl).
5. Utilizar la técnica de cristalización
fraccionada, para purificar una muestra de KNO3 contaminada con
NaCl.
6. Calcular el
porcentaje de sustancia pura que se obtiene por cristalización fraccionada.
MARCO
TEÓRICO
Una solución es una mezcla homogénea de composición variable pero limitada
por la solubilidad, se dice que es una mezcla porque tiene más de un componente
(soluto y solvente) que no reaccionan entre sí. La homogeneidad se debe a la
uniformidad en el sistema, es decir que presenta una sola fase, por ejemplo: un
volumen de aire representa un sistema de una sola fase que contiene más de un
componente (H2, N2,O2, Ar, Xe, etc).
Tipos de soluciones.
Según el estado físico:
|
Soluciones Sólidas
|
Ejemplo |
|
Gas en sólido |
H2 gaseoso en paladio |
|
Líquido en
sólido |
Empastes dentales (mercurio en plata) |
|
Sólido en
sólido |
Bronce (zinc/cobre) |
|
Soluciones Gaseosas |
Ejemplo |
|
Gas en gas |
Aire |
|
Sólido en gas |
Polvo en aire |
|
Líquido en gas |
Vapor de agua
en aire |
|
Soluciones Líquidas |
Ejemplo |
|
Gas en líquido |
CO2 en soluciones (refrescos) |
|
Sólido en líquido |
Azúcar en agua |
|
Líquido en
líquido |
Alcohol en
agua |
Según la cantidad relativa de sus componentes:
1.
No Saturada.
Puede ser:
a) Solución diluida es la que
contiene una cantidad relativamente pequeña de soluto.
b) Solución concentrada es la que
contiene una cantidad relativamente grande de soluto, pero sin llegar a la
saturación.
De acuerdo a lo
anteriormente expuesto puede deducirse que una solución no saturada contiene
menor cantidad de soluto que la que es capaz de disolverse.
2. Solución saturada.
Contiene la
máxima cantidad de soluto que se disuelve en un disolvente en particular, a una
temperatura específica.
3.
Solución sobresaturada.
Es la que
contiene más soluto que la contenida en una solución saturada del mismo soluto
a la misma temperatura. Estas soluciones no son muy estables, una parte del
soluto se separa de la disolución sobresaturada en forma de cristales, dando lugar,
el proceso inverso de disolución (la cristalización).
Como diferenciar estas soluciones:
- Si el soluto se disuelve todo o parte de él,
la solución es no saturada.
- Si el soluto no se disuelve ni produce
precipitación de lo que estaba disuelto, es una solución saturada.
- Si el soluto añadido produce la
cristalización de una parte del soluto que estaba disuelto, es una
solución sobresaturada.
Solubilidad y factores que afectan la
solubilidad.
El término
solubilidad, se define como la máxima cantidad de un soluto que se puede
disolver en una cantidad determinada de disolvente, a una temperatura
especifica, se expresa ordinariamente como los gramos de soluto contenidos en
S
= Masa de soluto (g) / Masa
del solvente (g) x
100 (6)
No todas las
sustancias son solubles en las demás sustancias. Algunos solutos son más
difíciles de disolver que otros, esto dependerá de algunos factores como:
1. Las propiedades del soluto y del
disolvente.
Cuando una sustancia se disuelve en otra, las partículas del soluto se
dispersan en el disolvente. Con frecuencia hemos escuchado la frase “lo semejante
disuelve a lo semejante”, lo que es de gran ayuda para predecir la
solubilidad de una sustancia en un determinado disolvente. Esta expresión
significa que es probable que dos sustancias cuyas fuerzas intermoleculares son
del mismo tipo y magnitud sean solubles entre sí. Por lo tanto, los compuestos
iónicos (polares) casi siempre son solubles en disolventes polares (Ejm: sal en
agua), y los compuestos covalentes (no polares o débilmente polares) se
disuelven en disolventes no polares (Ejm: tetracloruro de carbono en benceno).
2. La temperatura.
Según la
definición de solubilidad se puede inferir que la temperatura afecta la solubilidad
de la mayoría de las sustancias, este efecto debe determinarse en forma
experimental. Por lo general, la solubilidad de los sólidos aumenta con el
incremento de la temperatura. Sin embargo, hay algunas excepciones, como lo
indica el siguiente cuadro.
TABLA
15. Dependencia de la solubilidad con la temperatura.
|
Compuesto |
Gramos de soluto en 100 gr de agua |
|||
|
Nombre |
Fórmula |
a |
a |
a |
|
Hidróxido de potasio |
KOH |
97,00 |
144,00 |
178,00 |
|
Nitrato de potasio |
KNO3 |
13,30 |
85,50 |
246,00 |
|
Clorato de potasio |
KClO3 |
3,30 |
19,30 |
57,00 |
|
Cloruro de sodio |
NaCl |
35,63 |
36,67 |
39,12 |
|
Cromato de calcio |
CaCrO4 |
4,50 |
1,12 |
0,42 |
|
Hidróxido de calcio |
Ca(OH)2 |
0,14 |
0,10 |
0,06 |
|
Sulfato de zinc |
ZnSO4 |
41,9 |
76,80 |
80,80 |
3.
Las soluciones formadas solo por líquidos y sólidos no se ven afectadas
en forma apreciable por la presión. Sin embrago, las soluciones de gases en
líquidos o gas en gas tienen una influencia directa de la presión.
Curvas de solubilidad.
La
dependencia de la solubilidad con la temperatura puede expresarse gráficamente
mediante curvas de solubilidad (Figura 15), donde en el eje de las abscisas se
marca la temperatura y en el eje de las ordenadas, la solubilidad. Es el mejor
procedimiento para observar inmediatamente no sólo el valor de solubilidad sino
su variación con la temperatura
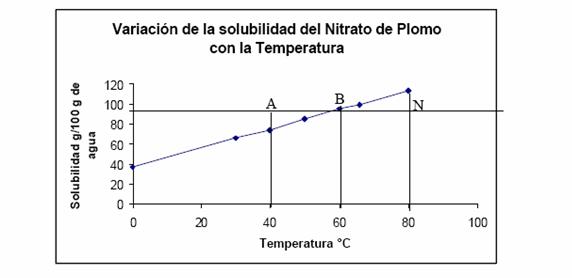
FIG. 15. Curva de solubilidad del nitrato de plomo
en agua.
En el gráfico
anterior el punto B indica que a
Por medio de la
curva de solubilidad se puede determinar gráficamente la solubilidad de las sustancias
a diferentes temperaturas, realizar cálculos necesarios para llevar a cabo una
cristalización fraccionada, empleada para la purificación de las sustancias
sólidas.
Cristalización fraccionada.
La cristalización fraccionada es la separación de una mezcla de sustancias
en sus componentes puros con base a sus diferentes solubilidades. Como ya se
había mencionado la mayor parte de las sustancias sólidas, especialmente las
sales, aumentan su solubilidad con la temperatura. Este aumento puede ser:
a) Rápido: Pb(NO3)2,
KNO3, K2Cr2O7.
b) Lento: KCl.
c) Muy pequeño: NaCl.
Sin embargo, existen compuestos, para los cuales su solubilidad disminuye
con la temperatura. Esto ocurre con algunos compuestos como el hidróxido de
calcio, el cromato de calcio, el acetato de calcio, el carbonato de litio, el
acetato de estroncio y el sulfato de cerio. Estas marcadas diferencias de la
solubilidad con respecto a la temperatura pueden utilizarse para llevar a cabo
la cristalización fraccionada.
La cristalización de las sustancias cuya solubilidad disminuye en función
de la temperatura puede lograrse bajando la temperatura de la solución saturada
(recristalización). Si la temperatura disminuye lentamente, la sustancia
cristaliza en forma de cristales grandes, si el enfriamiento es rápido, se
forman cristales pequeños. Los cristales pequeños son más puros, mientras que
el crecimiento de cristales grandes va acompañado de captura de cantidades
pequeñas de la solución madre que contiene impurezas provenientes de otras
sustancias. Para las sustancias cuya solubilidad aumenta con el descenso de la
temperatura, la recristalización se lleva a cabo en orden inverso: la solución
se satura con la sustancia dada a una temperatura lo más baja posible y después
se calienta hasta ebullición.
A veces hay que filtrar la solución saturada a
Ejemplo:
Para purificar
Si a
para disolver
Al enfriar la solución saturada desde
Si al enfriar una solución preparada a partir de
El rendimiento teórico debe ser:
% Rendimiento =
Sal cristalizada (
Cantidad
inicial de la sal (
El rendimiento de Pb(NO3)2
recristalizado constituye 54,4%.
PARTE EXPERIMENTAL
![]()
![]()
![]()
Solubilidad del KNO3
1.
Pesar
en un vaso de 30 ml,
2.
Agregar
al vaso con KNO3, 4
ml de agua destilada, agitar hasta disolver y medir la temperatura a la que se disuelve todo el soluto.
3.
Cuando
toda la sustancia este disuelta,
añadir una nueva porción (1,0000g), colocar en la plancha de calentamiento,
agitar hasta que se disuelva y medir de nuevo la temperatura cuando el soluto este
disuelto.
4.
Repetir
el procedimiento hasta agregar las cuatro porciones de KNO3
Solubilidad del NaCl.
1.
Pesar
en un vaso de 50 mL
2.
Agregar
al vaso con NaCl, 20 mL de agua, agitar hasta disolver y medir
temperatura a la que se disuelve todo el soluto.
3.
Agregar
una porción de
4.
Repetir
el procedimiento hasta agregar las otras porciones de NaCl (0,2000; 0,1000 y 0,1000g).
5.
Construya
en una misma gráfica, las curvas de Solubilidad vs Temperatura para las dos
sales.
Purificación de KNO3 contaminado con NaCl (Ver
Fig. 16)
1.
Pesar
en un vaso de 100 mL,
2.
Agregar
4 mL de agua en el vaso con la muestra.
3.
Calentar
a
4. Enfriar con baño de hielo ( 4 –
5.
Pesar
un papel de filtro, filtrar al vacío y colocar las aguas del filtrado en un
beaker de 250 ml previamente pesado.
6.
Colocar
el papel de filtro con los cristales sobre la tapa de la cápsula de Petri,
previamente pesada y secar en estufa a
7.
Pesar
los cristales y calcular el porcentaje de KNO3 recuperado.
8.
Evaporar
a sequedad el filtrado, colocándole al beaker un vidrio de reloj previamente
pesado,
como
tapa, dejar enfriar y pesar.
9.
Calcular
el porcentaje de cristales (residuo) recuperados.
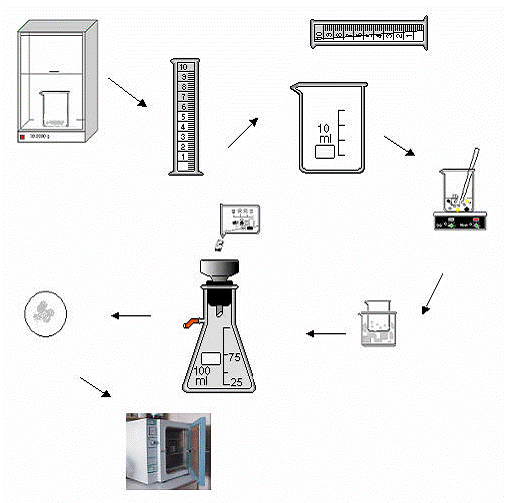
FIG. 16.
Dibujo esquemático para la purificación de KNO3 contaminado con NaCl.
DATOS EXPERIMENTALES
TABLA
16 . Solubilidad y Temperatura de disolución del KNO3 y NaCl.
|
Compuesto |
Masa de soluto (g) |
Temperatura de disolución (°C) |
Solubilidad g de
soluto / 100g de solvente |
|
KNO3 |
1,0000 |
|
|
|
2,0000 |
|
|
|
|
3,0000 |
|
|
|
|
4,0000 |
|
|
|
|
5,0000 |
|
|
|
|
NaCl |
6,0000 |
|
|
|
6,2000 |
|
|
|
|
6,4000 |
|
|
|
|
6,5000 |
|
|
|
|
6,6000 |
|
|
|
Masa de
la mezcla………………………………………………........... |
|
|
Masa del
papel de filtro………………………………………………... |
|
|
Masa del
cápsula de Petri……………………………………………… |
|
|
Masa del cápsula
de Petri + papel de filtro + cristales………………... |
|
|
Masa del beaker de 250………………………………………………... |
|
|
Masa del vidrio de reloj (tapa del beaker)……………………………... |
|
|
Masa del beaker + residuo + vidrio de reloj…………………………… |
|
RESULTADOS
|
Masa del
KNO3 recuperado…………………………………………... |
|
|
Porcentaje
del KNO3 recuperado de la muestra……………………….. |
|
|
Masa de cristales residuales
recuperados……………………………… |
|
|
Porcentaje de cristales residuales recuperados
………………………... |
|
CUESTIONARIO
1. ¿Cuál es la diferencia entre solubilidad y
concentración?
2. Tres frascos contienen soluciones
saturada, sobresaturada y no saturada de la misma sustancia.
¿Cómo
determinar qué solución hay en cada frasco?
3. A partir de los siguientes datos trazar la
curva de solubilidad en función de la
temperatura del Pb(NO3)2 y determinar su solubilidad a
|
Temperatura °C |
10 |
20 |
30 |
50 |
60 |
70 |
|
Solubilidad, g/100g de agua |
44,5 |
52,2 |
60,8 |
78,6 |
88,0 |
97,6 |
4. La solubilidad de una sal es igual a 64,7
y 13,8 g/ 100g de agua a
BIBLIOGRAFÍA
1. CHANG, R
y COLLEGE, W. Química.
Séptima edición. McGraw-Hill, México, 2002.
2. DAUB, W y
SEESE, W. Química.
Séptima edición. Prentice Hall, México, 1996.
3. BRICEÑO, C y CÁCERES, L. Química. Primera edición. Editorial Educativa,
Bogotá-Colombia, 1994.
4. PRETRUCCI, HARWOOD, y HERRING, G. Química General. Octava edición. Prentice
Hall,Madrid, 2003.
5. MOORE, KOTZ, STANITSKI, JOESTEN y WOOD. El Mundo de
6. MARTÍN,
D. Química, Disoluciones.
Segunda edición. Caracas, 1981.