UNIDAD I
|
|
GASES IDEALES
La necesidad de estudiar los gases ideales se explica
porque los
gases son fluidos ampliamente utilizados en una gran variedad de sistemas
como son los compresores y las turbinas a gas.
LEY DE BOYLE
Hacia el año 1660, Robert Boyle realizó una serie de experiencias, con las que determinó el efecto que ejerce la presión sobre el volumen de una determinada cantidad de aire. 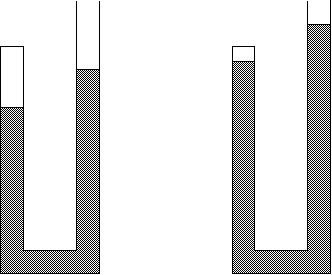
Fig. 1.25 Representación de la Ley de Boyle
“El volumen de un gas varía de forma inversamente proporcional a la presión si la temperatura permanece constante.”
LEY DE CHARLES Y GAY LUSSAC
En 1787 Charles y posteriormente Gay Lussac en 1808 demostraron
que, si la presión permanece constante el volumen del gas varía en forma
lineal con la temperatura.
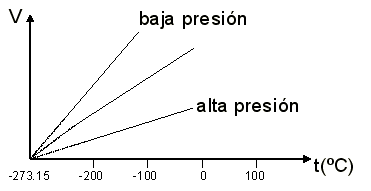
Fig. 1.26 Representación de la Ley de Charles
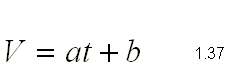
Para t = 0ºC V
= V0
y para t = -273.15ºC V = 0
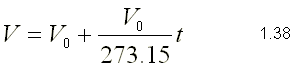
La extrapolación a bajas temperaturas de dichas rectas es muy
significativa pues tiende a V = 0 cuando la temperatura tiende a -273.15ºC
lo que aconseja la elección de una escala cuyo origen sea precisamente
esta temperatura. Esta escala es la ya conocida escala Kelvin:
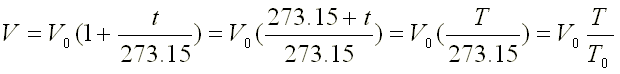 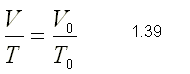
Este resultado expresa la ley de Charles-Gay Lussac que puede
enunciarse así:
“El volumen de una determinada cantidad de gas varía en proporción
directa con la temperatura si la presión permanece constante.”
Estas leyes la cumplen aproximadamente la mayor parte de los gases,
constituyendo ambas leyes dos características de los gases que se
denominan ideales.
LEY DE LOS GASES IDEALES Las leyes de Boyle y de Charles pueden cambiarse para proporcionarnos una ley más general que relacione la presión, el volumen, y la temperatura.
Consideremos una masa de gas que ocupa un Volumen V1 a la
temperatura T1 y presión P1. Supongamos que manteniendo constante la
temperatura T1, se produce una interacción mecánica entre el sistema y el
medio exterior, de forma que la presión alcanza el valor P2 y el volumen que
ocupa el gas se convierte en Vx. Para este proceso se cumplirá según la
ley de Boyle
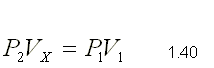 Si a continuación el gas interacciona térmicamente con el medio exterior, su presión seguirá siendo P2 mientras que la temperatura pasará a T2 y por consiguiente el volumen alcanzará el valor V2. Para este proceso de acuerdo con la ley de Charles 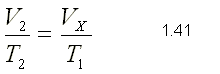
Igualando las ecuaciones 1.40 y 1.41 se obtiene:
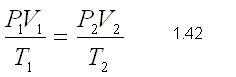 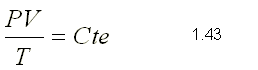
El valor de la constante se determina a partir de las consideraciones
de Avogadro. Este hace uso de razonamientos de naturaleza microscópica
para justificar el comportamiento macroscópico de la materia de diferentes
gases, que a la misma presión y temperatura contienen el mismo número
de moléculas; deduce que en un mol de cualquier sustancia existe el mismo
número de moléculas que calcula en 6.023x1023 .
Para un mol la hipótesis de Avogadro se suele formular diciendo que los
volúmenes ocupados por un mol de cualquier gas a igual presión y
temperatura son iguales.
Experimentalmente se comprueba que a 1 atm de presión y a una
temperatura de 0ºC ese volumen es 22. 4136 l (SI 101.325 kPa ; 0ºC, 1
kmol ocupará un volumen de 22.4136 m3 ).
El resultado dado por la ecuación puede expresarse en función del
número de moles de la sustancia, ya que el volumen es proporcional a
dicho número; luego podrá escribirse:
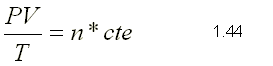
donde n = m / M siendo m la masa en kg y M la masa molecular del gas
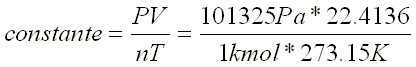 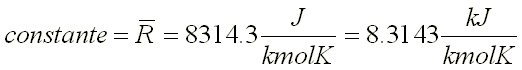
sustituyendo en 1.44 la constante universal
Otras formas:
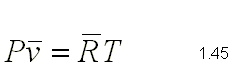 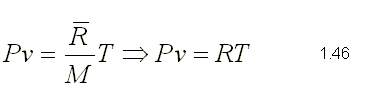
Donde R es la constante específica para cada gas.
|

Ver también: PROBLEMAS RESUELTOS SOBRE
GASES IDEALES
Ver también: PROBLEMAS RESUELTOS DE LA UNIDAD I
Ver también: PROBLEMAS PROPUESTOS DE LA UNIDAD I
